物理化学__华东理工大学
第九章 电解质溶液
单元测试卷
一、选择题(每小题1分,共30分) 1. 电解质HCl 在溶剂中电离HCl H ++Cl -并达到平衡,则未电离电解质HCl 的化学势HCl
µ与正负离子的化学势H µ+和-Cl µ之间的关系式为 。
A: HCl µ>H µ++-Cl µ;B :HCl µ=H µ++-Cl µ;C :HCl µ<H µ++-Cl µ
2. 24H SO 在溶剂中电离24H SO 242H +SO +?并达到平衡,
则未电离电解质24H SO 的化学势2
4
H SO µ与正负离子的化学势+H µ、24
SO µ?之间的关系式为 。
A: 2
4
H SO µ=+H µ+24
SO µ?;B :2
4
H SO µ=+2
H µ+24
SO µ?
;C :2
4
H SO µ=2+H µ+24
SO µ? 3. 在1-1型、1-2型、2-2型、3-1型第一类电解质溶液中,b ±=b 的是 。
A. 1-1型和2-2型;
B. 1-2型和3-1型;
C. 1-1型和1-2型
4. 在1-1型、1-2型、2-2型、3-1型第一类电解质溶液中,b ±>b 是 。
A. 1-1型和2-2型;
B. 1-2型和3-1型;
C. 1-1型和1-2型
5. 电解质溶液中含+4NH 、OH ?和+H 三种离子,它们的质量摩尔浓度分别记为a 、b 和 c (-1mol kg ?),则电中性条件是 。
A. 0a b c ++=;
B. a c b +=
;C. a c b ?= 6. 对于第一类电解质溶液,电解质作为整体的活度B a 与±a 间的关系为 。
A. ν±=a a B ; B . ±=a a B ; C. ν
/1B ±=a a
7. 要使K 2SO 4水溶液的离子强度I 与-11.20mol kg b ?的KCl 水溶液的离子强度相等,则
K 2SO 4水溶液的浓度b = -1mol kg ?。
A. 1.20; B . 0.80; C. 0.40
8. CuSO 4的水溶液与LaCl 3的水溶液,如它们的浓度相同,则两溶液的离子强度之比
()()43CuSO /LaCl I I = 。 A. 1.667; B . 0.667; C. 0.267
9. KCl 水溶液的浓度为1kg mol 20.1??=b ,则b ±= -1mol kg ?。
A. 0.80; B . 1.00; C. 1.20
10. 溶液中同时溶解有MgCl 2和KCl 两种盐,它们的浓度均为1kg mol 20.1??=b ,则溶液的离
子强度=I -1mol kg ?。
A. 2.40; B . 3.60; C. 4.80
11. 对于理想稀溶液,溶剂的渗透系数φx 1。
A. >; B . =; C. <
12. 溶液中同时溶解有MgCl 2和KCl 两种盐,采用ln Az z γ±+=MgCl 2的平均离子活度
因子时,正确的做法是 。
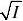
A. z +=2、z -=-1、离子强度只需考虑MgCl 2的贡献; B . z +=1、z -=1、离子强度包括所有离子的贡献; C. z +=2、z -= -1、离子强度包括所有离子的贡献
13. 今有浓度相同的三种电解质溶液,其价型分别为1-1型、2-1型和2-2型,则它们的平均离
子活度因子的大小排序为 。
第
页 1
物理化学__华东理工大学
A. (11)(21)(22)γγγ±?±?±?>>;
B. (11)(21)(22)γγγ±?±?±?<<;
C. (11)(21)
(22)γγγ±?±?±?== 14. 298.15K 时,浓度同为0.002-1mol kg ?的KCl 、CaCl 2、CaSO 4三种水溶液的平均离子活度因子分别为1γ±、2γ±、3γ±,则它们的关系为 。
A. 1γ±=2γ±=3γ±;
B. 1γ±<2γ±<3γ±;
C. 1γ±>2γ±>3γ±
15. 2Ni 2e Ni +?+→的电极反应,要得到2mol 的Ni ,则通过的电量为 。
A. 2F ;
B. 3F ;
C. 4F
16. 如果电解质溶液的导电依赖OH ?和K +的迁移和电极反应实现,已知OH ?离子的迁移速度约
为K +离子的3倍,则 。
A. K 1/4t +=,OH 3/4t ?=;
B. OH K /3t t ?+=, 但OH K 1t t ?++<;
C. OH K 0.5t t ?+== 17. 在电解水(事先加入了KOH )的过程中,电流的传导主要靠K +和OH -离子,它们对传导的贡献可用迁移数来表征,K 1/4t +=,OH 3/4t ?=且OH K 1t t ?++=。现假设电解水时加入的
电解质为KOH 和NaOH 两种,则+K OH t t ?+ 1。
A. >;
B. =;
C.<
18. 如果电解质溶液的导电依赖M +
和X -
的迁移和电极反应实现,已知M +和X -的电迁移率相
等,则 。
A. t t +?>;
B. t t +?=, 但1t t +?+<;
C. 0.5t t +?==
19. 有HCl 、KOH 、NaCl 三种稀的电解质溶液,浓度均为0.01mol ﹒dm -3 ,它们的摩尔电导
率m Λ值由大到小的正确排列是 。 A. HCl >KOH >NaCl ;B. KOH >HCl >NaCl ;C. HCl >NaCL >KOH
20. HCl 、NaAc 和NaCl 的无限稀释摩尔电导率分别为a ,b 、和c ,则HAc 的无限稀释摩尔电
导率等于 。
A. a +b +c ;
B. a +b -c ;
C. a -b -c
21. 291K 时,H 2SO 4溶液的浓度从3dm mol 01.0??增加到3dm mol 1.0??,其电导率和摩尔电导
率的变化情况为 。
A. κ增加,m Λ增加;
B. κ减小,m Λ增加;
C. κ增加,m Λ减小
22. 只有强电解质的电导率随浓度的变化才出现极大值,这一说法 。
A . 错误;B. 正确;C. 不确定
23. 科尔劳施经验公式m
m ΛΛ∞
=?的适用条件为 。 A. 强电解质稀溶液;B. 弱电解质稀溶液; C. 两者均适用
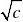
24. 有HCl 、KOH 、NaCl 三种浓度均相同的电解质溶液,它们的电导率κ值由大到小的正确
排列是 。
A. HCl >KOH >NaCl ;
B. KOH >HCl >NaCl ;
C. HCl >NaCL >KOH
25. 将电导率为0.141 S·m -1的某电解质溶液A 装进电导池,测得电阻为500Ω,将电解质溶液
B 装进同一电导池,电阻为1000Ω,则电解质溶液B 的电导率为 S·m -1。
A. 0.141;
B. 0.282;
C. 0.0705
26. 离子独立运动定律适用于 。
A. 强电解质稀溶液;
B.强电解质浓溶液;
C.无限稀释的电解质溶液
27. 298.15K 时,LiCl 和LiNO 3无限稀释摩尔电导率之差()()m m 3LiCl LiNO ΛΛ∞∞
?等于
3210.4910S m mol ??×??。下列两种盐的无限稀释摩尔电导率之差可以确认等于
3210.4910S m mol ??×??的是 。
A: ()()3m,NaCl m,KNO ΛΛ∞∞
?;B :()()3m,KCl m,KNO ΛΛ∞∞?;C :()()
3m,KCl m,NaNO ΛΛ∞∞? 28. 已知弱电解质溶液的无限稀释摩尔电导率为a ,现测得在某浓度下弱电解质溶液的摩尔电
第
页 2
物理化学__华东理工大学
第九章 电解质溶液
单元测试卷
一、选择题(每小题1分,共30分) 1. 电解质HCl 在溶剂中电离HCl H ++Cl -并达到平衡,则未电离电解质HCl 的化学势HCl
µ与正负离子的化学势H µ+和-Cl µ之间的关系式为 。
A: HCl µ>H µ++-Cl µ;B :HCl µ=H µ++-Cl µ;C :HCl µ<H µ++-Cl µ
2. 24H SO 在溶剂中电离24H SO 242H +SO +?并达到平衡,
则未电离电解质24H SO 的化学势2
4
H SO µ与正负离子的化学势+H µ、24
SO µ?之间的关系式为 。
A: 2
4
H SO µ=+H µ+24
SO µ?;B :2
4
H SO µ=+2
H µ+24
SO µ?
;C :2
4
H SO µ=2+H µ+24
SO µ? 3. 在1-1型、1-2型、2-2型、3-1型第一类电解质溶液中,b ±=b 的是 。
A. 1-1型和2-2型;
B. 1-2型和3-1型;
C. 1-1型和1-2型
4. 在1-1型、1-2型、2-2型、3-1型第一类电解质溶液中,b ±>b 是 。
A. 1-1型和2-2型;
B. 1-2型和3-1型;
C. 1-1型和1-2型
5. 电解质溶液中含+4NH 、OH ?和+H 三种离子,它们的质量摩尔浓度分别记为a 、b 和 c (-1mol kg ?),则电中性条件是 。
A. 0a b c ++=;
B. a c b +=
;C. a c b ?= 6. 对于第一类电解质溶液,电解质作为整体的活度B a 与±a 间的关系为 。
A. ν±=a a B ; B . ±=a a B ; C. ν
/1B ±=a a
7. 要使K 2SO 4水溶液的离子强度I 与-11.20mol kg b ?的KCl 水溶液的离子强度相等,则
K 2SO 4水溶液的浓度b = -1mol kg ?。
A. 1.20; B . 0.80; C. 0.40
8. CuSO 4的水溶液与LaCl 3的水溶液,如它们的浓度相同,则两溶液的离子强度之比
()()43CuSO /LaCl I I = 。 A. 1.667; B . 0.667; C. 0.267
9. KCl 水溶液的浓度为1kg mol 20.1??=b ,则b ±= -1mol kg ?。
A. 0.80; B . 1.00; C. 1.20
10. 溶液中同时溶解有MgCl 2和KCl 两种盐,它们的浓度均为1kg mol 20.1??=b ,则溶液的离
子强度=I -1mol kg ?。
A. 2.40; B . 3.60; C. 4.80
11. 对于理想稀溶液,溶剂的渗透系数φx 1。
A. >; B . =; C. <
12. 溶液中同时溶解有MgCl 2和KCl 两种盐,采用ln Az z γ±+=MgCl 2的平均离子活度
因子时,正确的做法是 。
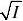
A. z +=2、z -=-1、离子强度只需考虑MgCl 2的贡献; B . z +=1、z -=1、离子强度包括所有离子的贡献; C. z +=2、z -= -1、离子强度包括所有离子的贡献
13. 今有浓度相同的三种电解质溶液,其价型分别为1-1型、2-1型和2-2型,则它们的平均离
子活度因子的大小排序为 。
第
页 1
物理化学__华东理工大学
导率为b ,则电解质在该浓度下的解离度等于 。 A. a +b ;B. a /b ;C. b /a 29. 在一定温度下,实测微溶盐溶液的电导率为a ,同温度下水的电导率为b ,则微溶盐的溶解度为 。 A. m a b Λ∞?; B. m a Λ∞; C. m
b Λ∞
30. 采用m m αΛΛ∞=计算解离度,下列正确的叙述是的 。
A. 适用于所有电解质;
B. 适用于弱电解质;
C. 适用于强电解质
二、(每小题5分,共10分)
1. 强电解质3LaCl 溶液的质量摩尔浓度为b ,平均离子活度因子±γ。试分别写出该电解质溶
液的±b 、±a 以及ν
±a 与b 的关系。
2. 计算1kg mol 0.2??=b 的2MgCl 水溶液在25℃时的平均离子浓度、平均离子活度、电解质作
为整体的活度。已知051.1=±γ。
三、(此题总分10分) 298.15K 时,氯化银饱和溶液的溶度积为6210dm mol 1072.1???×,纯水的电导率为
14m S 1060.1???×,银离子和氯离子的无限稀释摩尔电导率分别为4109.61?×和4104.76?×12mol m S ???。计算氯化银饱和溶液的电导率。
四、(此题总分10分)
浓度为3dm mol 001.0??的42SO Na 溶液的电导率12m S 106.2???×=κ。若将4CaSO 溶于上述溶液中,达饱和后测得此溶液的电导率12m S 100.7???×=′κ。已知
124m mol m S 101.50)Na (??+∞
??×=λ,1242m mol m S 105.59)Ca 2
1(??+∞??×=λ。设这两种溶液均可视为无限稀释的溶液。试求:42SO Na 溶液的摩尔电导率)SO Na (42m Λ以及4CaSO 在42SO Na 溶液中的溶解度。
五、(此题总分10分)
电解质溶液的电导率测定实际是测量其电阻,而电导率κ与电阻R 的关系可表示为:κ=K cell /R 。对于一个固定的电导池,K cell 为定值,称为电导池常数,单位为m -1。298.15K 时将电导率为0.141 S·m -1的KCl 溶液装进电导池,测得电阻为525Ω,如在该电导池中装进0.1 mol·dm -3的NH 4OH 溶液,测得电阻为2030Ω,计算NH 4OH 的解离度和解离平衡常数。已知:421m 4(NH )73.410S m mol λ∞+??=×??,421m (OH )198.310S m mol λ∞???=×??。
六、(此题总分10分)
298.15K 时,测得SrSO 4饱和溶液的电导率为1.482×10-2 S·m -1,纯水的电导率为1.50×10-4 S·m -1。计算在该条件下SrSO 4在水中的溶解度(以mol·m -3表示)。
第 页 3
物理化学__华东理工大学
已知:()23211m 2Sr 5.94610S m mol λ∞+??=×??,()23211m 42SO 7.9810S m mol λ∞???×??;
七、(此题总分10分)
298 K 时,在一溶液中,CaCl 2和ZnSO 4的浓度均为1kg mol 002.0??,试用德拜-休克尔极限公式计算ZnSO 4的平均离子活度因子。已知1/21/21.1709 mol kg A ?=?。
八、(此题总分10分)
298.15K 时,TlCl 在纯水中的饱和浓度为231.60710mol dm ??×?,在30.1000 mol dm ??NaCl 溶液中的饱和浓度为333.9510mol dm ??×?,TlCl 的4sp
2.02210K ?=× 。试求: 1. 在不含NaCl 的TlCl 饱和水溶液中,TlCl 的平均离子活度因子;
2. 在含有30.1000 mol dm ??NaCl 的TlCl 饱和溶液中,TlCl 的平均离子活度因子。
第 页 4
本文来自投稿,不代表微盟圈立场,如若转载,请注明出处:https://www.vm7.com/a/wendang/9907.html

